İlgili Yazı
XL-MS Neden İlaç Hedefi Keşfini Hızlandırıyor
2025-12-25İlaç Hedef Keşfi, yeni bir ilacın etkilemesi gereken vücuttaki spesifik molekülleri bulma sürecidir. Başarılı kanser tedavileri, birçok kinaz inhibitörü ve PD-1/PD-L1 antikorları gibi bağışıklık kontrol noktası ilaçları, İlaç Hedef Keşfi'nde atılımlarla başladı. Araştırmacular hastalıkları tetikleyen proteinleri arar, rollerini doğrular ve ardından onları modüle etmek için küçük moleküller veya biyolojik maddeler tasarlarlar. Ancak hastalıklar daha karmaşık hale geldikçe, geleneksel yöntemler çoğu zaman doğru hedefleri doğru zamanda ortaya çıkarmakta zorlanıyor. Gerçek biyolojik ortamlarda protein etkileşimlerini nasıl daha net görebilir ve adaydan onaylanmış hedefe daha hızlı geçiş yapabiliriz? İşte XL-MS oyunu değiştirmeye başlıyor...
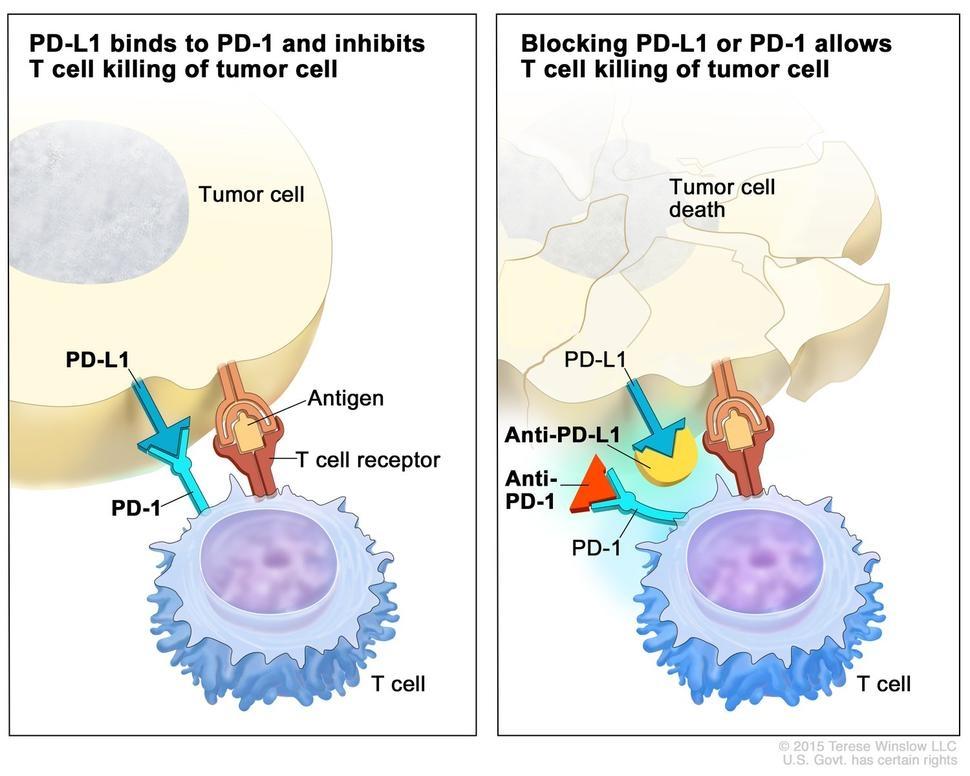
(Bağışıklık Kontrol Noktası İnhibörleri – NCI)
Uyuşturucu Hedeflerini Görmek benn Gerçek Etkileşim Ağları
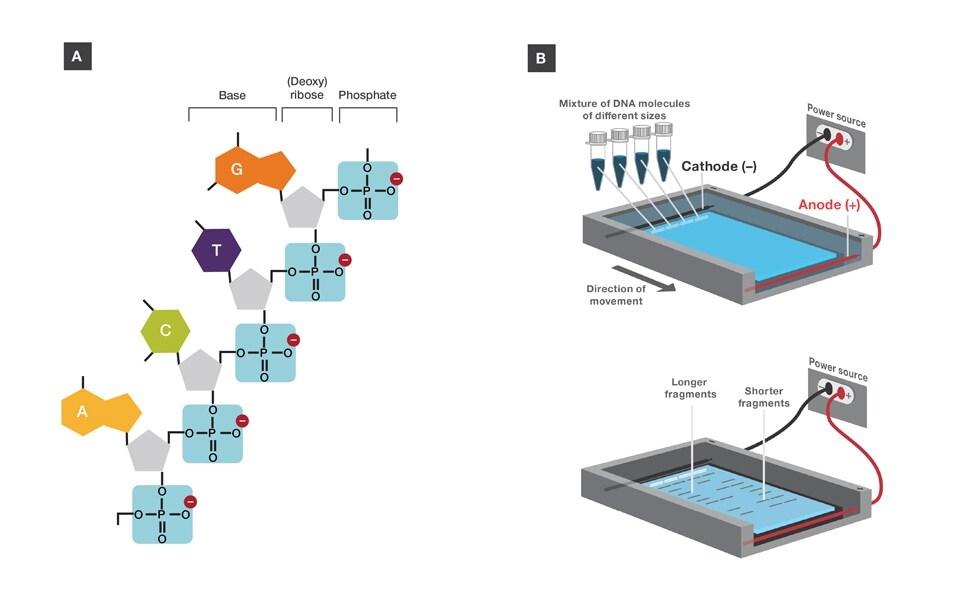
XL-MS (çapraz bağlamalı kütle spektrometrisi) Çok basit bir fikirden başlar: İki protein birbirine yeterince yakın oturursa, çapraz bağlayıcı onları birbirine kilitleyebilir. Bu bağlantı kurulduğunda, kütle spektrometrisi çapraz bağlı peptitleri tespit edebilir ve proteinlerin hangi bölgelerinin dahil olduğunu gösterebilir.
Pratikte, bu, çapraz bağlama ajanlarının hücre lizatlarına veya saflaştırılmış komplekslere doğrudan eklenebileceği anlamına gelir. Bu reaktifler, yakındaki amino asitler arasında kovalent bağlar oluşturur ve protein-protein etkileşimlerini etkili bir şekilde "dondurur". Önemli olarak, bu genellikle arınma veya yıkama adımlarında kaybolan zayıf, geçici veya koşullara bağlı etkileşimleri içerir.
Drug Target Discovery için bu detay seviyesi son derece değerli. Çoğu ilaç hedefi, büyük multiprotein kompleksleri veya sinyal yolları içinde çalışır. Sadece tek bir proteinin yapısını bilirseniz, hikayenin sadece bir kısmını görürsünüz. XL-MS ile şunları yapabilirsiniz:
•Hangi proteinlerin hedefinizle doğrudan etkileştiğini haritalayın
•Etkileşimde yer alan yaklaşık bağlanma noktalarını veya alanlarını bulmak
•Sağlıklı ve hastalık örnekleri arasındaki etkileşim kalıplarını karşılaştırın
• Aday bileşiklerin belirli temasları nasıl bozabileceğini veya stabilize edebileceğini takip edin
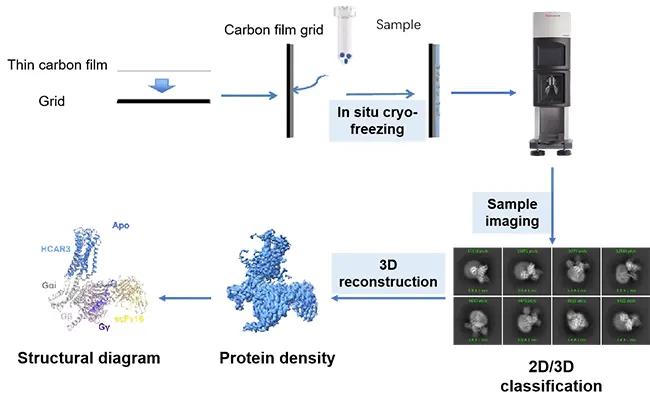
XL-MS, kriyo-EM ve X-ışını kristalografisi gibi yapısal yöntemlerle de iyi birleşir. Yapısal biyoloji size yüksek çözünürlüklü anlık görüntüler sunar. XL-MS, özellikle çözülmesi zor olan esnek bölgeler için modelleri doğrulamaya veya geliştirmeye yardımcı olan mesafe kısıtlamaları ve etkileşim kalıpları ekler. Birlikte, ilaç hedefinizin kalabalık moleküler ortamda nasıl davrandığına dair daha gerçekçi bir tablo sunarlar.
XL-MS Neden Modern İlaç Hedefi Keşfi Süreçlerine Uyuyor
Birçok ekip bize aynı şeyi söylüyor: protein etkileşimleri hakkında daha derin bir içgörü istiyorlar ama tüm programı yavaşlatacak bir yöntemi kabul edemezler. XL-MS, iş akışınızı tamamen yeniden tasarlamanızı gerektirmeden zengin biyolojik bilgi sunması nedeniyle caziptir.
Günlük projelerde öne çıkan birkaç pratik avantaj:
•Yüksek Veri Verimliliği, Yüksek Bilgi İçeriği
XL-MS, karmaşık örnekler ve büyük çalışmalar için oldukça uygundur. Çapraz bağlama ve sindirim optimize edildikten sonra, gelişmiş kütle spektrometreleri tek bir çalışmada birçok örneği işleyebiliyor. Otomatik veri işleme ise ham spektrumları etkileşim haritalarına dönüştürür ve ekibinizin deneyden yoruma daha hızlı geçmesine yardımcı olur.
•Daha Yerli Koşullarda Çalışmalar
Çapraz bağlama hücresel veya fizyolojik ortamlarda yapılabildiği için, yüksek arındırılmış proteinlerle sınırlı değilsiniz. Bu, yalnızca belirli koşullarda oluşan etkileşimleri yakalamanızı sağlar; örneğin kofaktörlerin varlığı, membran ortamları veya hastalıkla ilgili stres sinyalleri. İlaç Hedefi Keşfi için, bu, adaylarınızın in vivo olanları daha iyi yansıtan bir bağlamda değerlendirilmesi anlamına gelir.
•Özel Protein Etiketlemesine Gerek Yok
XL-MS, her protein için özel kimyasal etiketler veya genetik etiketler gerektirmez. Bu, deneysel karmaşıklığı azaltır, potansiyel artefaktların etiketlenmesini engeller ve birçok hedef ile koşulda ölçeklendirmeyi kolaylaştırır.
• Zayıf ve Geçici Etkileşimlere Duyarlı
En önemli düzenleyici olaylardan bazıları düşük eğilimli veya kısa ömürlü kompleksleri içerir. Geleneksel aşağı çekme veya arındırma temelli tekniklerle ortadan kaybolabilecek etkileşim türleri tam olarak bunlardır. Çapraz bağlama, bunları gerçekleştiği anda yakalar, size daha eksiksiz bir etkileşim ağı sağlar ve Uyuşturucu Hedefi Keşfi sırasında kör noktalardan kaçınmanıza yardımcı olur.
Bu faydalar bir arada toplandığında, araştırma ekiplerinin hedefleri daha akıllıca önceliklendirmelerini sağlar. Sadece kolayca ölçülebilecek şeylere odaklanmak yerine, biyolojik olarak anlamlı olanlara odaklanabilirsiniz – aynı zamanda zaman çizelgelerini ve bütçeleri kontrol altında tutarak.
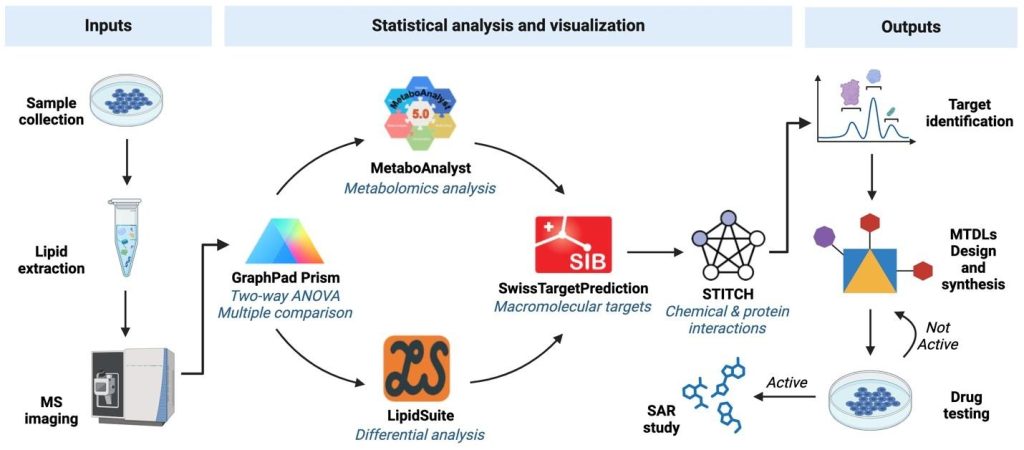
(Glioblastoma İlaç Keşfi için Çok Hedefli Yönlendirilmiş Ligandlar ve Lipidomik Yaklaşım)
Longlight teknolojisi XL-MS iş akışlarını uçtan uca nasıl destekliyor?
Longlight Technology'de, XL-MS'yi tek bir deney olarak değil, İlaç Hedef Keşfi için entegre bir çözümün parçası olarak konumlandırıyoruz. Birçok grup, sıfırdan tam bir XL-MS boru hattı kuracak dahili bant genişliğine sahip değildir, bu yüzden hizmetlerimizi mevcut araştırma sürecinize entegre edecek şekilde tasarlıyoruz.
Bize önceden çapraz bağlanmış örnekler gönderebilir veya bilim insanlarımızla iş birliği yaparak sisteminize uygun çapraz bağlama stratejisi oluşturabilirsiniz – uygun çapraz bağlamalar, koşullar ve kontroller seçerek. Bundan sonra Longlight Technology, örnek sindirme, çapraz bağlı peptid zenginleştirme, kütle spektrometrisi edinimi ve veri analizi dahil olmak üzere her teknik adımı üstleniyor. Protein etkileşim partnerlerini haritalayan, çapraz bağlantı noktalarını belirleyen ve hedef ile eylem mekanizması kararlarınızla en ilgili yapısal bilgileri damıtan net, proje hazır bir rapor alırsınız.
XL-MS'in ötesinde, Longlight Teknolojisi İlaç Hedefi Keşfi etrafındaki üst ve aşağı akış çalışmalarını da destekler. Genomik çözümlerimiz, yeni nesil dizileme ile ilgili cihazlar ve reaktifler dahil olmak üzere, genetik varyantları, ifade değişikliklerini ve hastalık yollarıyla bağlantılı düzenleyici unsurları belirlemenize yardımcı olur. ChIP-seq gibi teknikler, XL-MS tarafından oluşturulan protein – DNA etkileşimlerini protein-protein etkileşim haritalarına bağlayarak, hedeflerin kromatin düzenlemesi ve transkripsiyon ağlarında nasıl oturduğuna dair daha geniş bir bakış sunar.
Laboratuvarınızın sorunsuz çalışması için, araştırma ve biyofarmasötik ortamlarda tutarlı, günlük kullanım için tasarlanmış nüklein asit ekstraksiyon kitleri, kütüphane hazırlık kitleri, prekast agaroz jelleri ve özel tüpler gibi çeşitli tüketim malzemeleri ve kitler de sunuyoruz. Görev, her aşamayı – hazırlık, ölçüm ve analizi – basitleştirmektir; böylece bilim insanlarınız kurulum ve sorun gidermeye daha az zaman harcayabilir ve önemli hipotezleri daha fazla test edebilirler. XL-MS'yi etkileşim haritalama, genomik platformları ve stabil laboratuvar araçları için bir araya getirmek, daha koordineli ve etkili bir İlaç Hedef Keşfi iş akışı sunar. İzole deneyler yerine, sürekli olarak daha iyi verileri daha iyi kararlara aktaran bir boru hattı inşa edersiniz.
Kuruluşunuz keşif döngülerini kısaltmak, riski azaltmak ve potansiyel ilaç hedeflerinin gerçek biyolojik sistemlerde nasıl davrandığına dair daha net bir tablo elde etmek istiyorsa, sizi desteklemekten memnuniyet duyarız.
Bir sonraki İlaç Hedef Keşfi projeniz için XL-MS'yi keşfetmekle ilgileniyor musunuz?
Hedeflerinizi, örneklerinizi veya çalışma tasarımınızı tartışmak için Longlight Technology ile iletişime geçin ve karmaşık protein etkileşim verilerini somut, uygulanabilir içgörülere dönüştürmenize yardımcı olmamıza izin verin.